El sistema inmune es el encargado de combatir los agentes patógenos y las enfermedades que producen. Para hacerlo utiliza básicamente dos tipos de mecanismos, uno es la inmunidad innata y el otro la inmunidad adquirida.
La inmunidad innata abarca la acción de células y mecanismos inmunes que defienden al organismo contra infecciones de forma inespecífica. Por el contrario, la inmunidad adquirida abarca las células y mecanismos de defesa específicos contra un determinado patógeno o grupo de patógenos relacionados.
Dentro de la inmunidad adquirida o específica, está la inmunidad adquirida mediada por células, llevada a cabo por líneas concretas de los linfocitos o células T, y la inmunidad adquirida mediada por anticuerpos, también llamada inmunidad humoral.
Los anticuerpos son moléculas proteicas de la familia de la inmunoglobulinas (Ig) que son producidos por linfocitos B maduros y diferenciados en células plasmáticas o plasmocitos.
Cada anticuerpo es producido para reconocer de forma específica frente a una molécula presente en un determinado agente patógeno, por eso se considera como una respuesta inmune específica. Además, la producción del anticuerpo requiere un contacto previo con el agente patógeno, de ahí que se diga que es un tipo de inmunidad adquirida.
En el sistema inmune humano hay 5 grandes tipos de anticuerpos (isotipos) que se diferencian a nivel molecular y estructural, pero también en el tipo de respuesta inmunológica que producen y en el momento en el que intervienen durante el período de lucha contra una enfermedad.
En orden alfabético, los cinco tipos de anticuerpos son:
- IgA
- IgD
- IgE
- IgG
- IgM
Estos cinco tipos de anticuerpos son compartidos por todos los mamíferos, no son exclusivos de la especie humana, pero en otros animales se pueden encontrar otros tipos de inmunoglobulinas. Por ejemplo, IgY en pájaros y reptiles, o IgW en elasmobranquios (tiburones y rayas).
A continuación veremos cual es la estructura general de las inmunoglobulinas y cuales son las características y diferencias más importantes de cada tipo de anticuerpo.
Índice de contenido
Estructura general de los anticuerpos
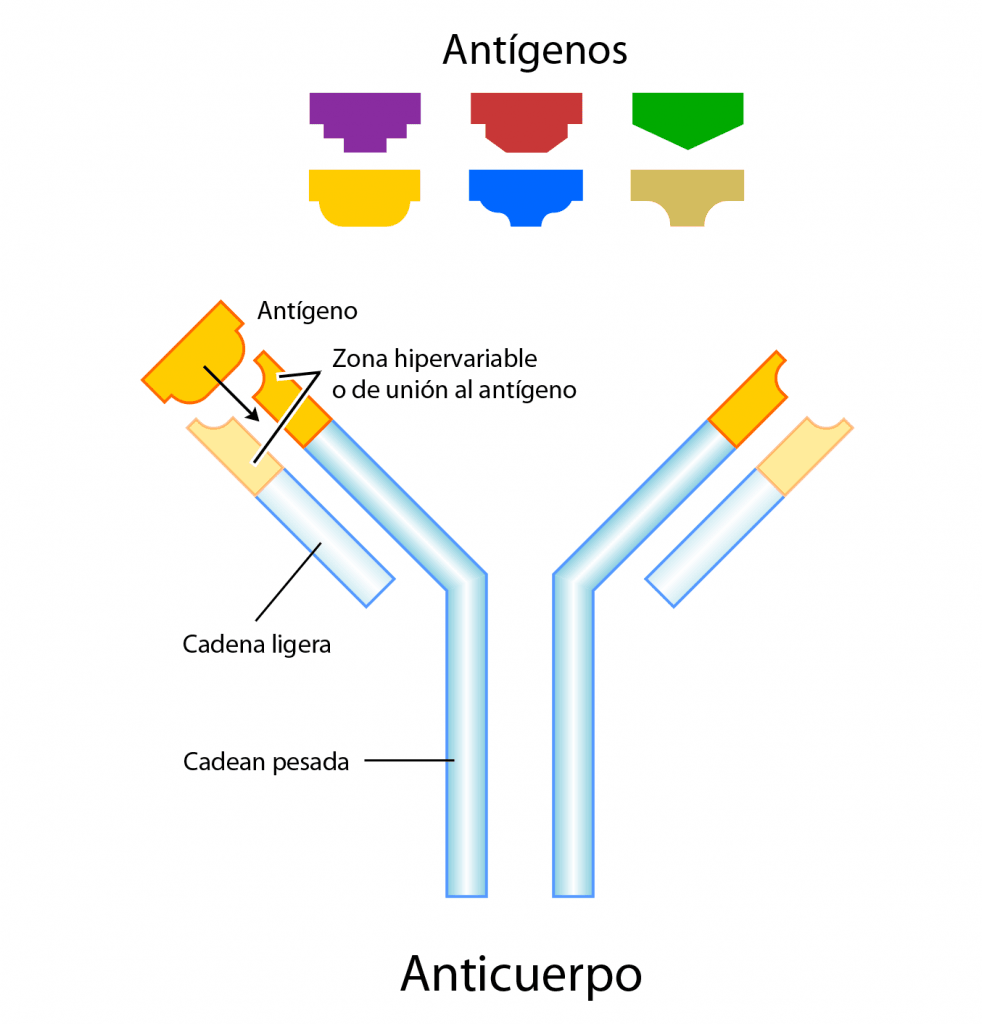
Aunque hay varias clases de anticuerpos, todos comparten una estructura general similar. Químicamente son glicoproteínas, pues tienen un parte proteica y una parte glucídica, que pueden superar los 150 kDa de masa y los 10 nm de longitud.
La parte proteica es una globulina en forma de Y formada por cuatro cadenas, dos pesadas y dos ligeras, que en el ser humano pueden ser varios tipos:
- Cadenas ligeras (2): lambda (λ) y kappa (κ).
- Cadenas pesadas (5): alfa (α), delta (δ), epsilon (ε), gamma (γ) y mu (μ).
Las cadenas se unen entre sí mediante enlaces disulfuro y según la combinación de cadenas ligeras y pesadas se forman los diferentes tipos de anticuerpos, pero cada Ig siempre tiene dos cadenas pesadas iguales y dos cadenas ligeras iguales.
Tanto en las cadenas ligeras como en las pesadas hay una zona que se mantiene constante dentro de un mismo tipo de anticuerpos, y otra zona que es variable, a veces llamada zona hipervariable. La zona o dominio variable es la que interacciona con el antígeno, y por eso precisamente es tan variable, para poder sintetizar moléculas específicas para cada antígeno.
En las cadenas ligeras hay un dominio variable y un dominio constante, mientras que en las cadenas pesadas puede haber dos o más dominios constantes. Por ejemplo, la cadena pesada tipo ε tiene 1 dominio variable y 4 dominios constantes.
La molécula descrita formaría un monómero o unidad de inmunoglobulina, pero la forma activa de algunos tipos de anticueripos son polímeros formados de varias unidades. Por ejemplo, la IgA suele formar dímeros y la IgM suele formar pentámeros.
Regiones
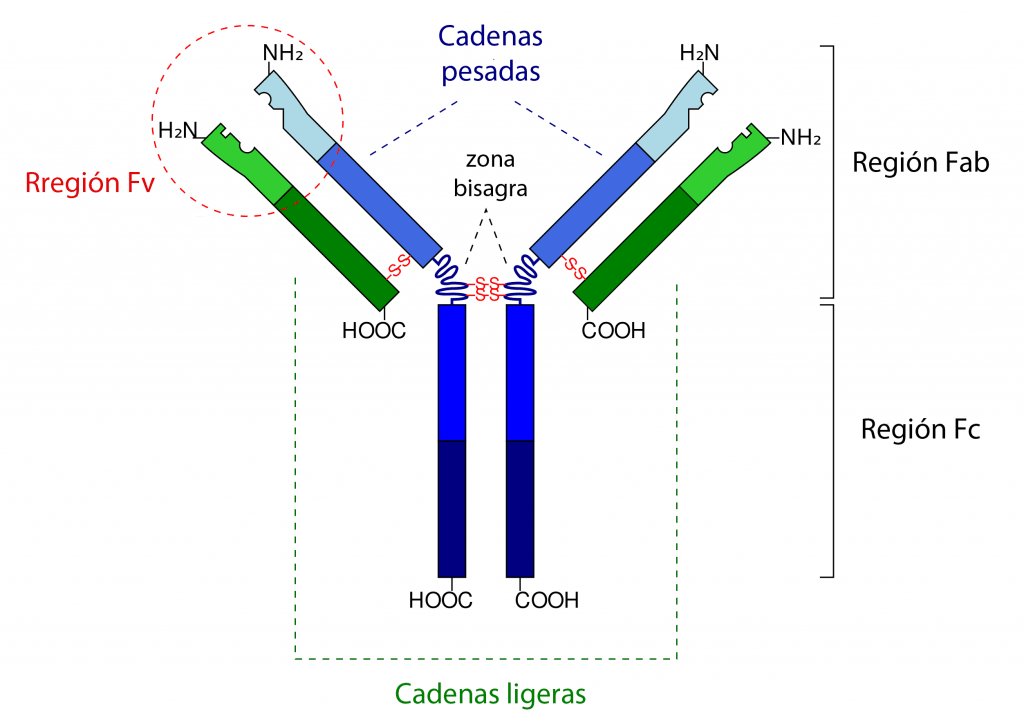
Además de los cadenas ligeras y pesadas, y de los dominios constantes y variables dentro de cada cadena, en cada unidad de inmunoglobulina se distinguen otras regiones estructurales y funcionales:
- Región Fab: abarca los dominios variables y dominios constantes que forman los brazos de la «Y». También se conoce como región de unión al antígeno (antigen binding, de ahí el nombre de «ab»).
- Región Fv: está formada por la combinación de una zona variable de la cadena ligera y la zona variable adyacente de la cadena pesada. Incluye solo los dominios variables localizados en los extremos de los brazos de la «Y».
- Región Fc: está formada la cola de la «Y» y solo incluye dominios constantes de la cadena pesada. No incluye los dominios constantes de la región Fab.
Tipos de anticuerpos
Los anticuerpos de nuestro sistema inmune se clasifican en 5 clases o isotipos. Algunos isotipos cuentan con varios subtipos.
Cada isotipo se nombra con las siglas «Ig», de inmunoglobulina, y una determinada letra en función del tipo de cadena pesada que tienen:
- IgA cadenas pesadas tipo alfa (α)
- IgD cadenas pesadas tipo delta (δ)
- IgE cadenas pesadas tipo delta epsilon (ε)
- IgG cadenas pesadas tipo delta gamma (γ)
- IgM cadenas pesadas tipo mu (μ)

IgA
La IgA está formada por cadenas pesadas tipo alfa y presenta cuatro sitios de unión a antígenos. Existen dos subtipos estructurales, IgA1 e IgA2. En la IgA2, las cadenas pesadas alfa no se unen mediante puentes disulfuro, sino a través de interacciones moleculares no covalentes.
La IgA es característica en mucosas como el tracto digestivo, respiratorio y urogenital, y en secreciones como saliva, lágrimas y leche materna. Aquí se conoce como IgA secretora (sIgA) y la mayor parte se encuentra en forma polimérica de entre 2 y 4 monómeros, pero el más abundante es el dímero, con dos IgA unidas.
En circulación se conoce como IgA sérica y se presenta fundamentalmente en forma de monómeros. Tanto en suero como en secreciones puede haber IgA1 e IgA2, pero la IgA1 suele ser el subtipo predominante. La diferencia entre la IgA sérica y la IgA secretora es que la IgA secretora presenta un oligosacárido añadido por las células epiteliales de las mucosas durante la secreción.
En condiciones normales, la IgA sérica representa aproximadamente el 13% de todos los anticuerpos séricos. El 80% de la IgA sérica es tipo IgA1 y el 20% tipo IgA2. En las mucosas y secreciones la IgA2 puede llegar al 35%.
Función
La IgA secretora tiene un papel crucial en la función del sistema inmune en las mucosas, donde ejerce como una primera línea de defensa contra infecciones. Al pasar a través de la leche, la IgA contribuye al sistema inmune del bebé mientras su sistema inmune madura.
En circulación, la IgA interacciona con los receptores CD89 de linfocitos T efectores para iniciar una respuesta inflamatoria que involucra citotoxicidad dependiente de anticuerpos, la degranulación d eosinófilos y basófilos, activación de monocitos, macrófagos y neutrófilos, y el aumento de la actividad de los polimorfonucleares en el sistema respiratorio.
IgD
La IgD está formada por inmunoglobulinas con cadenas pesadas tipo delta y se produce en forma de monómeros de aproximadamente 185 kDa.
La IgD representa menos del 1% del total de anticuerpos séricos y casi toda se encuentra como receptor de membrana en las células B que no han sido activadas. La IgD suele ser coexpresada en la superficie de estos linfocitos junto a IgM de membrana.
En forma libre en el suero apenas representa el 0.25%.
Función
Su función exacta no se conoce bien, pero parece estar relacionada con la activación y diferenciación de linfocitos B en plasmocitos. También se ha encontrado IgD unida a receptores de basófilos y mastocitos, por lo que podría participar en la activación de estas células.
IgE
La IgE está formada por cadenas pesadas tipo epsilon. Se produce en forma de monómeros de aproximadamente 200 kDa.
Es el tipo de anticuerpo menos abundante de todos, tan solo representa el 0.02% de las inmunoglobulinas séricas en condiciones normales. Se encuentra en mayor cantidad en las mucosas del sistema respiratorio e intestinal.
Función
La IgE ofrece protección inmunitaria frente a posibles patógenos en las mucosas gastrointestinales y respiratorias, sobre todo frente a gusanos parásitos, por ejemplo contra helmintos.
También se conoce como anticuerpo reagínico por estar implicado en la reacciones de hipersensiblidad y reacciones alérgicas.
Los sitios de unión antigénica se unen a receptores de membrana de basófilos y mastocitos, las células inmunitarias que producen los síntomas típicos de las reacciones de hipersensibilidad, en concreto en la reacción de hipersensibilidad tipo 1 que se manifiesta en enfermedades como asma alérgico, sinusitis o rinitis alérgica.
IgG
La IgG está formada por inmunoglobulinas con cadenas pesadas tipo gamma. Se produce en forma de monómeros de un peso molecular alrededor de los 150 kDa.
Es el tipo de anticuerpo más abundante de todos, representando entre el 75 y el 80% de los anticuerpos del suero sanguíneo. También es el mayoritario en el fluido extracelular.
Existen cuatro subtipos, IgG1, IgG2, IgG3 e IgG4. El más abundante de todos es el IgG1. Los tipos IgG3 e IgG4 son los dos únicos anticuerpos capaces de atravesar la placenta y dar protección al feto.
Función
La IgG, al ser la mayoritaria en circulación, ofrece protección contra patógenos en casi todos los tejidos y órganos. También es el único anticuerpo que protege al feto.
La IgG activa la ruta clásica del sistema del complemento, una parte del sistema inmune que mejora la respuesta de los anticuerpos y de las células fagocíticas contra patógenos y células dañadas. También es uno de los anticuerpos más activos en la opsonización, que consiste en cubrir a los patógenos con anticuerpos para atraer a los macrófagos.
Tiene un papel importante en la citotoxicidad mediada por anticuerpos y la proteolisis intracelular mediada por anticuerpos. Además, la IgG está asociada con las reacciones de hipersensibilidad tipo II y tipo III.
IgM
La IgM es la inmunoglobulina formada por cadenas pesadas tipo mu. Es el anticuerpo más grande que produce el sistema inmune humano, pues la forma libre más abundante es un pentámero de 5 unidades de IgM que puede superar los 900 kDa de peso molecular.
También se produce como inmunoglobulina de membrana en forma de monómeros, solo las IgM secretadas forman los pentámeros.
Función
La IgM es coexpresada junto a IgD en los linfocitos B no activados para ayudar en el reconocimiento de antígenos. Además interviene en la opsonización y aglutinación de patógenos y activa al sistema del complemento.
Es el tipo de anticuerpo que se produce más rápido tras el contacto con un agente patógeno, por eso es el anticuerpo principal en la respuesta humoral primaria. Según el tipo de estímulo, los linfocitos B activos cambiarán hacia los isotipos IgG, IgA o IgE, en la respuesta humoral secundaria.