Cuándo hablamos de cofactores, rápidamente pensamos en enzimas, coenzimas y, si tienes formación en bioquímica, puede que también pienses en grupos prostéticos. Todos estos términos están íntimamente relacionados y diferenciarlos no siempre es fácil. En este artículo intentaremos definir claramente que es un cofactor, que tipos existen y que características son propias de cada uno.
Olvídate las definiciones que diferencian un cofactor de una coenzima según su naturaleza inorgánica u orgánica. Aunque estas definiciones sean muy comunes en Internet, son definiciones erróneas.
Índice de contenido
¿Qué es un cofactor?
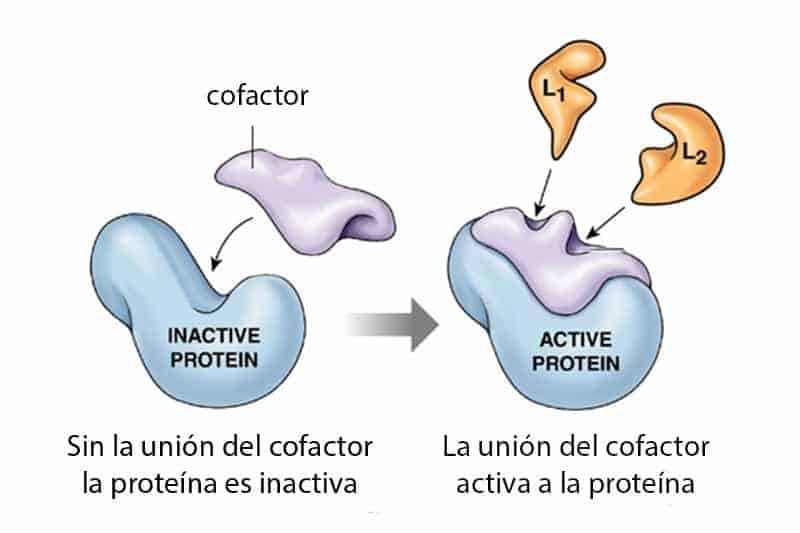
Se define como cofactor a toda sustancia de naturaleza no proteica que es requerida para que una proteína ejerza su actividad biológica. La mayoría de las veces esta proteína es una enzima, de ahí que se utilice el término cofactor prácticamente como sinónimo de cofactor enzimático, pero hay que tener claro que no son exactamente lo mismo ya que un cofactor puede ejercer su función en una proteína no enzimática.
Cofactores enzimáticos
Prácticamente el 100% de las reacciones metabólicas que ocurren en cada momento en las células de nuestro cuerpo están catalizadas por enzimas, macromoléculas orgánicas de carácter proteico que aumentan la velocidad de reacciones químicas que sin su acción ocurrirían muy lentamente.
Cada enzima necesita condiciones muy específicas para un funcionamiento óptimo y son muy sensibles a pequeños cambios de temperatura, pH, concentración de sustrato y producto, concentración de la propia enzima y otras variables fisicoquímicas.
La actividad de las enzimas también se puede ver afectada por la presencia de otras sustancias. A las sustancias que inhiben la acción de las enzimas se las conoce como inhibidores enzimáticos, mientras que las sustancias que favorecen su actividad se las conoce como activadores enzimáticos. Los activadores incrementan la velocidad de las reacciones enzimáticas pero no tienen por qué ser necesariamente requeridos para que la enzima muestre actividad.
Sin embargo, algunas enzimas necesitan obligatoriamente de otras sustancias para mostrar su actividad o catalizar alguna reacción concreta. Se podría decir que estas enzimas necesitan «activadores obligatorios» y son estos activadores obligatorios los que reciben el nombre de cofactores. Los cofactores pueden ser de naturaleza y características muy variadas, desde pequeños iones metálicos mono-atómicos hasta moléculas orgánicas de cierta complejidad como las coenzimas y grupos prostéticos.
Por tanto, una coenzima y grupo prostético son dos tipos de cofactores. Veamos con más detalle que es cada uno de ellos y que características los definen.
Tipos de cofactores
Los cofactores se pueden clasificar atendiendo a diferentes criterios, uno de los más comunes es según su naturaleza orgánica o inorgánica:
- cofactores inorgánicos: iones metálicos (Mg2+, Cu+, Mn2+) y los centros hierro-azufre.
- cofactores orgánicos: las coenzimas, por ejemplo la flavina, y los grupos prostéticos, por ejemplo el grupo hemo. Como veremos a continuación, la diferenciación entre coenzima y grupo prostético es algo difusa y hay autores que proponen el uso de sólo uno de los dos términos y abandonar el otro.
Cofactores inorgánicos: iones metálicos y centros hierro-azufre
Los iones metálicos son cofactores muy comunes y de ellos los más frecuentes son iones metálicos compuestos por uno o dos átomos. En el ser humano, la lista de estos cofactores incluye frecuentemente al hierro, magnesio, manganeso, cobalto, cobre, zinc y molibdeno, todos ellos oligoelementos esenciales en nuestra dieta debido precisamente a su papel como cofactores.
Algunos elementos inorgánicos participan en la regulación alostérica de enzimas pero no se consideran cofactores de las enzimas que regulan. Por ejemplo, el calcio participa en la regulación alostérica de la oxido nítrico sintasa, proteína fosfatasa o la adenilato kinasa, entre otras muchas, pero no es un cofactor de estas enzimas.
Otro tipo de cofactores inorgánicos son los centros hierro-azufre. Estos centros son complejos formados por grupos sulfuro, generalmente provenientes del aminoácido cisteína, unidos a dos o cuatro átomos de hierro. Además del papel funcional como cofactores, los centros hierro-azufre desempeñan una función estructural fundamental en la conformación espacial de la proteína. Algunos ejemplos de proteínas con centros hierro-azufre son la ferredoxina, NADH deshidrogenasa o la Coenzima Q – citocromo c reductasa.
Algunos cofactores incluyen elementos inorgánicos unidos a moléculas orgánicas. Estos cofactores suelen incluirse en el grupo de cofactores orgánicos por el mayor peso de la fracción orgánica. Por ejemplo el grupo hemo.
Cofactores orgánicos: coenzimas y grupos prostéticos
Las coenzimas y los grupos prostéticos son dos tipos específicos de cofactores de naturaleza orgánica. Suelen ser moléculas pequeñas, usualmente de masa menor a 1000 Da. Para diferenciar entre ambos se suele atender a la fuerza o tipo de unión entre el cofactor y la proteína: una coenzima se une de forma débil mientras que un grupo prostético se une fuertemente y generalmente no se puede separar de la proteína si esta no se desnaturaliza.
Esta diferenciación entre coenzima y grupo prostético no es muy clara ya que no hay una definición exacta entre que es una unión fuerte y unión débil. Además, un mismo cofactor puede unirse débilmente a una proteína y hacerlo más fuertemente a otra. Incluso algunas sustancias consideradas tradicionalmente como coenzimas tienen una unión covalente a su enzima, lo que iría en contra de esta definición por ser un tipo de unión claramente fuerte.
La única diferencia obvia es que el término coenzima se refiere específicamente a cofactores enzimáticos mientras que los grupos prostéticos pueden ser cofactores de proteínas sin actividad enzimática. Para terminar con esta confusión y tener una definición exacta, algunos autores han propuesto abandonar el término coenzima en favor de grupo prostético para referirse a todos los cofactores orgánicos en general y utilizar coenzima para referirse específicamente a cofactores orgánicos enzimáticos.
También se ha propuesto el uso del término cofactor para denominar a una sustancia diferente de la proteína y del sustrato que es requerida para la actividad de la proteína, y el uso del término grupo prostético para denominar a sustancias que se mantienen unidas covalentemente a la proteína durante todo el ciclo catalítico. Una coenzima podría caer en ambos grupos en función del modo de acción. En cualquier caso, todavía no hay un consenso inequívoco adoptado por la comunidad científica.
Ejemplos de coenzimas y grupos prostéticos
Los ejemplos más comunes de coenzimas son vitaminas y derivados. No todas las vitaminas actúan como coenzimas pero es una actividad muy frecuente entre ellas. En el grupo de las vitaminas B encontramos numerosos ejemplos, como la coenzima A, que es un derivado del ácido pantonénico (vitamina B5), o los cofactores NAD+ y NADP+, que son derivados de la niacina (vitamina B3).
El grupo hemo es un ejemplo típico de grupo prostético. En general, las proteínas que contiene el grupo hemo se conocen como hemoproteinas. Este grupo incluye proteínas con importantes funciones biológicas. Por ejemplo, la hemoglobina y mioglobina (implicadas en el transporte de O2), varios citocromos (implicados en el transporte de energía química) o las enzimas catalasa y óxido nítrico sintasa endotelial.